实例1:
湿热灭菌设备的温度验证
1温度验证程序规划底子请求
湿热灭菌的底子程序规划底子请求源于US.FDA在上世纪70年代中期提出的,且在80年代施行的:“对于大容量注射剂GMP技能性准则”五个方面请求:
(1)在灭菌工序应能确保商品到达F0 ≥ 8;
(2)灭菌前,待实验的容器中有**高带菌量,污染菌应具有**强的耐热性;
(3)每一个灭菌釜的每种装载办法及每种规范容器的验证实验均**少运用10支热电偶进行热散布实验;
(4)用待实验容器灌注粘度相类似的商品进行热穿透实验,找出容器中升温**慢点的方位,**少运用10个容器,每个均参加恰当的生物指示剂并且插有热电偶。当灭菌釜的参数现已到达热散布实验现已证实的可重现情况,温度到达设定的灭菌温度时,开端测定F0 值,直到开端冷却止;
(5)当商品到达灭菌温度直到开端冷却的进程,温度改变有必要坚持在±0.5℃以内。
2温度验证的功用测验进程
由此技能规划请求动身,演化变成如今G内广泛选用的湿热温度验证的大容量注射剂实验办法和实验用具,也是温度验证程序规划的底子请求。运用其作功用测验进程及参阅设备如下:
前提: 湿热灭菌设备的设备测验合格,现场和共用工程外接条件完备。即通常讲(DQ,IQ)现已完毕后,方位在OQ运转承认。
2.1热散布测验
意图:找出**冷点方位,查验重现性。进程:(1)设备仪器校对;(2)热电偶散布图;(3)空载热散布实验,3次以上;(4)热电偶刺进图;(5)装载(模仿出产装载**大,**小量)热散布实验,各3次以上。
2.2热穿透测验
意图:必定灭菌进程中被测验各点取得无菌确保值,格外是**冷点方位的F0 值,监测查验重现性。进程:(1)设备校对;(2)模仿出产灭菌装载;(3)热电偶装载图;(4)同品同规商品**大与**小装载热穿透实验,每情况3次以上。
2.3 生物指示剂测验
意图: 挑战性模仿出产或许要素形成的微生物污染程度来查验灭菌牢靠性,对验证规划进行查验。进程:(1)计划的规划拟定;(2)生物指示剂菌株的挑选,测定D值;(3)标定浓度和拟定样品;(4)接种,装载;(5)低限灭菌(每商品,每规范每种灭菌程序**少3次以上);(6)样品的培育与辨别;(7)评估定论(数据,样品剖析)。
2.4 差错与调整
重新规划后,重复上面进程。
2.5 填写验证实验陈述书
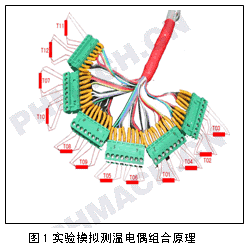 3湿热灭菌温度验证对验证仪器的底子请求
3湿热灭菌温度验证对验证仪器的底子请求
按前所述温度验证程序规划请求的技能准则的五方面内容,验证设备可包含三有些:(1)测温元件;(2)测温修改记载仪器;(3)辅佐校对仪器。
3.1测温元件
测温元件选用灵敏的多枝精细铂电阻或电偶构成,原理如图1。接线较长能够独立的摆放在灭菌设备中选定方位,每支的差错在±0.5℃以下的测验精度规模。
校对时,发作差错越程件应挑选。这是由于差错越程后在后面的核算中将导致F0 违背,简略带来误判作用。
电偶是温度到势能的变换器,而电阻是温度到阻值的变换器,两者在输出的信号上是不相同的。从输出特性灵敏度看精细铂电阻(RTD) 为优。从测温规模上比照(-180~2000℃),价性比上热电偶较优。
所以,经典教科书上和**对于出产公司设备温度验证仍引荐热电偶。它是验证的温度信号采集器(精细的多只双眼)。如今开发先进的仪器选用无线信号传送作为测温元件。测温记载仪就近接纳发来的每一个信号,主动完结变换和记载、存储,但造价贵重,格外小气,保管有格外的请求, 如今对于旋转釜G内已有运用。在灭菌釜的实习温度验证实验仪器上,G内外现已开发和出产出老练的部件和比照先进的仪器,如GE.Kaye(US) 、raytek(US)、Sakura 、multi(Japen) 、Schlumbergez(England) 、 Goodwill(台湾固纬)、Validator2000(北京祥鸿) 等温度验证仪。
3.2测温修改记载仪器
测温记载仪器是全部实验的大脑。G内外许多公司直接选用PC机开发,在Windows 体系渠道根底上开发自个的多点数据记载、收拾、核算、存储及I/O的接口软件,其集多功用软件为一体装配在核算机中,既便带着,又图文完备,直观牢靠。
3.3辅佐校对仪器
规划为一台高精度的恒温油槽(又称干井,见图2),选用温控PID调理控温精度高,温度动摇规模规划在±0.05℃。其有断偶保护功用,上限规划超温报警功用。升降温迅速、安稳、牢靠。在设定温度和丈量温度数字上,别离3又1/2准确显现。
在低温段检校采纳冰点槽(低温干井)设备,高低温干井别离查看电偶的格外点温度值差错和能否用于实验的合格性进行鉴别挑选。它便是本实验的查看校对部件,也是实验室的常备精细温度源。通常交G家法定技能监督有些定时检校承认合格,在有效期内运用。 #p#分页标题#e#
4电偶的安顿及被灭菌物装载
从G内许多温度验证作业打开与公司观赏的实习中,**都必定被灭菌物装载及电偶的安顿对温度验证定论有必定的影响。集中反映的疑问有以下几方面:
(1)电偶前端有些不要触摸周边介质(被灭菌装载物,笼架,柜壁)。汽流和高温水流对其冲击不会发作磕碰触摸和位移;
(2)釜(胆)体喷淋板孔阻塞或加工飞边毛刺将影响水流及安顿的设备平行度,也将影响水量散布和流向;
(3)猜测高温点(蒸汽进口)、低温点(凝结排放或循环水出口)与同步点(电偶方位与本柜规划查看探头处相同方位)的接线、编号与摆放办法有误。
装载物(模仿灭菌出产类似物)的摆放模仿办法越挨近实习出产,和影响热传递的模仿商品的液体粘度越挨近灭菌药品粘度,摆放的电偶数量(10
在2.4(3)所触及点外,别的点挑选视设备有所不相同。如喷淋式灭菌柜,过热水是由上**下活动传递热量,验证技师着重堆码底层和堆码基地是查核要点,主张摆放在底层均布为重;又如SVP脉动灭菌釜,则着重堆码底层挨近排气口周围的安顿是查核要点;再如喷淋旋转式灭菌柜,过热水是由外**里活动传递热量,验证技师着重中剖面四角和基地是查核要点,主张摆放呈轴向中部层为重。而某些**格外研讨后,提出仍以牢靠性和准确性为安顿意图的中心思维。但是,需求对不相同釜形作具体剖析和实验注重均布性,取缺点代表。
值得留意的是在设定灭菌程序必定(如121 ℃/15分,115℃/35分等)后,温度实验验证采纳的实验规划参数,其装载办法和出产灭菌的正常选用办法是相同的、固定的,否则会形成查看差错。格外强求的是,模仿出产现场条件的相似性和共同性是适当shou要的条件要素。
实习的LVP设备均为多笼车和大产值(有上万瓶/柜)的高效型。对冷点与次冷点的查看和判别有必要是屡次数据的概括定论。但是,运用进程存在冷点、次冷的漂移和改动属再验证承认。
高温点的操控判别也是有必要监测的参数,这将触及到药品的高温药效评估。探头缺乏的情况下,能够固定装载办法后,经单笼车屡次测验与比照,步步迫临搜索冷点、次冷点、高温点等参数。一起,应和实习的出产装载办法共同,不得改动装载办法以确保运用差错的**小化和数据的准确性。
当然,依照出产现场的模仿情况进程上应有**小装量和**大装量,每品每规**少3次(如设备太大,探头不行而分段测验,则数据将更多),**少3组安稳数据来查核设备的重现性和挑选热散布参数的准确性。
加上校对、安顿、辅佐装载、查看、纪录剖析等是验证班技工好几周的作业量。可见,实验的艰苦和细致请求,如此费神费力是由于它的准确性对后面作业有十分shou要的指导性含义。
5热穿透实验及规范灭菌时刻F0
热量在物理学中有传导、对流和辐射三种底子传递办法,其概括产生了强壮的热穿透作用,大家关怀的是热穿透作用,故取名为热穿透实验。早些书本上有称它为带商品负荷的热散布实验,如今依然以热穿透实验的称谓居多。意图是为了用前述实验的极值点来查核其F0值,对现已灭菌的商品是不是被赋予规划的灭菌确保值进行具体数据查看查核。
本实验的进程和办法与装载和前述的热散布实验大体相同,不相同在于温度探头的安顿是插在商品中,不触摸药品容器周边和底部。摆放在下列方位,并一一对应作好编号:
(1)热散布实验断定的**冷点和次冷点;
(2)热散布实验断定的**热门和次热门;
(3)和灭菌柜温度操控规划探头并排(又称同步点);
(4)纪录腔室温度探头(不刺进商品中),别的和热散布方位适当,均匀安顿。
每点的温度纪录后依照时刻距离(30秒或1分)具体纪录打印,并核算每点从升温到降温进程中100℃上的F0值、各点总的F0均值、**大与**小值要害数据。
探头运用前后都要在冰点槽和油浴槽中细心的校对,除掉超差件。在确保重现性十分好的情况下,安稳实验数据不得低于3组。也即是本实验在某种类规范和对应某装载固定不变的工况下**少需安稳情况下作3次实验。可接受的规范是:
(1)灭菌规划程序下各点热穿透实验取得的F0值底子共同;
(2)**冷点F0值和商品的F0 均值之间差值小于2.5(参数的参阅解释见《药品出产验证攻略》1996版,221);
(3)全体的F0值督查剖析,其没有在规划的F0值答应动摇的公役上下限外数据;
(4)具有杰出的重现性,接连三次以上重现性)。
以F0值作为督查剖析的历史由来已久,从经典的材料查阅能够找到,湿热灭菌中微生物杀灭的对数规矩始于1921年Bigeow和Rahn等科学家的研讨。他们论文的shou要作用是:
灭菌时微生物逝世遵从对数规矩,进程能够用阿仑乌斯(Arrhenius)的一级反应式来描绘。根据质量作用定律,在安稳温度及坚持其它条件不改动的情况下,单位时刻内被杀灭的微生物数正比于初始的原有数目,能够标明为以下的线性式:#p#分页标题#e#
dN/dt = K (No-N k ) …………(1)
收拾后lg N t = lg No – ( K/2.303) t
取其斜率的负倒数界说为D值,D= 2.303/K= t/ (lg No - lg N t ),取(lg No - lg N t )=1,D= t, 则为微生物被杀灭90%的时刻。也称谓微生物九成杀灭时刻,单位为分,D为正值。在USP中,D值则标明灭菌的程度。D值区别不相同的微生物,在不相同的温度和介质情况下数值不相同,具体的数据是能够查阅的,其值越大标明微生物越难杀灭。
跟着灭菌温度增加,杀灭耗用的时刻越短。实验在(100~138℃)规模lg D与温度有线性关系,取其斜率的付倒数界说为Z值:
Z = (T2 – T1 )/ lgD 1- lgD2 ---------------(2)
Z值代表微生物被杀灭减低一个lg D数量单位所需增加的温度数值,代表微生物对热灵敏系数,其值越大对热越不灵敏。单位为℃ ,Z 为正值。实验挑选强耐热菌株(嗜热脂肪杆菌B.Stearothermophilus)为代表的Z值在多种介质中为9.4 ,考虑Z值挑选10,从安全视点既留有安全地步且对数核算运用上十分简洁。
D2 / D 1 = 10 (T1 – T2) / Z 带入测验时刻距离Δt和作用时刻多项累计求和,将T2设为参比温度T0,在变温情况下的灭菌等效式求F值核算收拾,F值的数学表达式是一个多项和作用,也有直接以积分办法写出的代表式。数学多项表达式对物理特性表达较为直观:

Δt 为丈量被灭菌物温度的时刻距离(通常选用1分或0.5分),分为单位;
T为每个Δt时刻距离测得的被灭菌物温度值,℃为单位;
T0是参比温度值,℃为单位;
Z为微生物数下降一个对数lgD值所需求增加的温度数,℃为单位;
F ,分为单位。
它的物理含义是在变温条件下t分钟灭菌作用与温度T0 (参比温度)时F分钟的灭菌作用相同等效。这是很有含义和具有十分适用价值的表达式,由于工业出产灭菌是不或许在一会儿完结,长时刻温度安稳不变的肯定抱负情况也是不存在的,因此在实习的出产操作中将广泛触及该式。
当Z值取10℃时,这个数学表达式就剩余实测温度T和距离时刻Δt两个变量,代表各个温度值下的灭菌作用转化为121 ℃规范温度下Z值10℃下的灭菌时刻作用,并记为F0值
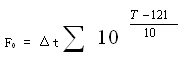
上式直接由温度T和时刻Δt两个物理量决议,某些书本又称物理F0 (规范灭菌时刻)。物理F0如今仅限于湿热灭菌,在实验中需求留意不能与干热、辐射等灭菌规范数据相混杂。
它包含灭菌进程的升、保、降温进程三皆段热能对微生物总致死量作用,其是以时刻为单位标明在灭菌温度121℃时等效的量值(以时刻的量值来标明的代用值)。
F0代用值能代表无菌吗?以 F0≥8为题打开,牵扯到一个简略和无菌概念混杂疑问,在1995年前世界上许多从事无菌和灭菌商品的大家把F0≥8视为(当成)商品灭菌规范,如同F0≥8就等同到达商品无菌请求,而忽视其具体技术污染操控手法疑问。这是不对的,这对无菌请求在概念上属知道性的过错。
F是指特定操控情况下被灭菌商品被污染的概率低于某值概念,赋予了商品必定的安全性而言,其是在制作进程(技术)别的的染菌要素有必要严厉操控的特定情况下的。F0≥8在本规划程序下能杀灭到何种程度?是对于不相同的商品和带有不相同染菌数而规划的。不相同染菌数样本能够在F0≥8情况下灭菌完毕采纳验算承认残存数或许辅之采样培育予以承认。在微生物失控情况下,底子不能称无菌。由此可见:
没有严厉的技术制作进程染菌操控,即便F0≥8 也不能到达无菌请求,反之相同。所以,USP23(1211)不再提出将F0≥8即契合无菌请求的条款写入。因此,此概念也不能简略套用到别的无菌概念,也不能讲F0 到达多少后就到达无菌请求,这本不是同一概念。
当然,在规划灭菌程序参数时应充沛考虑增大被灭菌物的安全性,通常扩大F0需作屡次谨慎验证实验后才递出技术批改陈述。不能轻易扩大F0,由于它是它是一把双刃剑,过度(过热)灭菌成果对药品来说很简略药效报废,并分出难以操控的杂质或(毒)副产物,破坏药品质量,而形成一系列精心操作进程的前功尽弃,过度灭菌商品相同对病员无益。
如今回头查看热穿透屡次实验的作用。如现已到达可接受的规范了,则标明在灭菌柜**冷点(次冷点)以及**高温点(次高温点)的到达规划请求,极限点的数据标明灭菌是在规划操作程序可操控规模。既可确保腔内药品被赋予规划的满足安全性,又不在影响药效的过度灭菌温度规模。一起,同步点查看合格意味设备自身外表反映的参数也是实在牢靠,设备规划、制作与设备调试是合格的。这么为设备验证合格奠定了极好的根底,也为商品灭菌质量确保锁上了“榜shou把锁”。#p#分页标题#e#
6生物指示剂实验(也称为挑战性实验)
触及湿热灭菌的生物指示剂实验指将必定量的已知D值微生物耐热孢子接种到待灭菌的商品中,在设定的灭菌程序条件下限灭菌,以验证设定的灭菌技术程序是不是的确赋予商品所设定的F0值,由此进行的实验和评估进程也称为挑战性实验。操作进程如下:
6.1验证计划拟定的要点在商品的热安稳性、商品的污染水平与污染菌的耐热数据。
(1)商品剖析(接种模仿污染水平≥出产污染水平);
(2)断定菌种孢子,挑选强于商品多见污染菌的热耐受菌种孢子(菌种孢子含量的准确性,质量材料具有可追溯性,在有效期内);
(3)挑选非致病菌,且具有杰出的重现功用;
(4)应在接种一起留置多支阳性对照品,实验进程同步采样培育。
6.2充沛选用热散布及热穿透的作业数据。
装载和样品依照热穿透安顿不变。格外注重灭菌釜的**冷点、次冷点以及同步点样品编号。
6.3设置实验温度灭菌限(也称低限灭菌)
既低于规划值,比F0 低3 %~5%进行灭菌。由此而规划灭菌程序时刻,如灭菌值F0 商品核算下限为8.5,规划为8.3限。
6.4按拟定下限灭菌程序完毕
(1)QC现场采样,实验编号数据和对照品编号数据同步搜集;
(2)样品依照断定菌种孢子培育请求(通常在特定温度和有好氧与厌氧条件区别);
(3)实验样品和阳性品同条件别离培育观测。如阳性品正常培育失利,既可判实验无效而失利。因盾之不存,矛的锋利无从谈起。
6.5为查看验验的重现性
每一种类规范的灭菌程序**少应进行3次以上的实验,实验的数据有必要安稳共同,重现性杰出。否则,查找要素,重新开端。
生物指示剂挑战性实验是一项典型的灭菌安全性评估验证,需求技术人员实验技师和QC方面亲近的配合和准确的规划。到达2.6.4与2.6.5可接受的规范后,能够证实实验成功,它代表技术规划的灭菌程序与参数是合理的,也赋予了商品满足的安全性。另一方面,也证实前期设备的挑选是契合出产需求的硬件。
操作拟定的SOP、SMP把出产技能操作进程置于可控规模,**此本项验证作业能够告完毕,转入下一项定时再验证流程。这么,为将来商品灭菌质量确保锁上了“第二把锁” 。
实例2
2.湿热灭菌柜的验证
2.1评估规范和验证内容
在1992年版世界卫生组织的《规范》第17章,说到对注射剂的验证请求:
(1)17.32条:一切设备如灭菌柜、空气过滤体系、水处理体系(包含蒸馏水机)均应按计划进行验证、保护和监控。
(2)17.55条:任何灭菌办法在正式选用前,该办法对商品的适用性以及每一装载办法下被灭菌品的一切部位是不是到达规则灭菌请求都应经过验证。应定时进行再验证,每当设备有严重改动时,也须进行再验证。
而在98版《药品GMP查看攻略》中:
(1)3102条:灭菌柜的才干是不是与出产相适应,是不是具有主动监测及记载设备。
(2)*5703条:要害设备及无菌药品的验证内容是不是包含灭菌设备、药液滤过及灌装(分装)体系。
由上可见,灭菌工序对于注射剂出产的shou要作用以及药政有些对灭菌柜验证的注重。而对于灭菌柜的验证,美GFDA和欧盟药品卫生组织对于不相同的灭菌柜有具体的指引和请求(能够查阅有关的官方页面),我G在这方面只有02年版的《药品验证攻略》大容量注射剂章节中给出对于灭菌柜验证的比如,一起05版的《药典》中对于灭菌法有些也给出更具体的请求。咱们大多是参照它来拟定评估规范的,笔者参阅攻略的比如把全部灭菌柜验证简略概括为以下几个方面:
(1)预承认,对灭菌柜的底子功用是不是到达公司的请求进行承认;
(2)设备承认,包含文件承认、图纸查看、shou要机械部件查看、安全体系查看、共用管道衔接查看、仪器外表查看和校对、操控体系硬件有些查看、操控体系软件功用完成查看、备件备品的查看等;
(3)运转承认,包含功用测验和底子功用参数的承认,以及对上述设备承认内容的运转时动态承认,一起根据实习情况修订操作规程和对操作人员进行实操训练;
(4)功用承认,包含验证仪器的校验、空载热散布(腔室平均温度与冷点温差小于1.5℃)、满载热散布(腔室平均温度与冷点温差小于1.5℃)、满载热穿透的实验以及生物指示剂的挑战性实验。其间,**shou要的衡量规范是灭菌期间冷点和平均温度之差小于0.5℃和终究F0值大于8。
2.2灭菌柜验证操作进程
对于预承认和设备与运转承认的内容在此省掉,由于这和别的制药设备验证的底子准则是相同的。另需留意的是对于灭菌柜的安全有些和操控有些的承认,由于灭菌柜是压力容器,安全防护的措施和设置是必不行少的,这些措施既有机械方面的也应该有电器和PLC程序方面的,而灭菌作用怎么则取决于操控程序和探头的精度等要素,所以要掌握要点。在完结了以上的三种承认今后,就进入功用承认。#p#分页标题#e#
(1)验证用的仪器,shou要由三有些构成:高精度的测温探头(进口PT100热电阻温度探头)、用微机制成的测温文传送集成体系以及手提电脑(shou要是电脑上用VB编写的和数据库衔接的验证仪记载软件)。
(2)运用曾经当然即是要进行校对。
(3)校对完了今后就依照布点图进行布点。1)空载热散布是指柜内不放任何玻璃瓶,只放空的灭菌架进入腔体;2)满载热散布是指按**大装载量把玻璃瓶放满灭菌架中,然后探头是放于瓶外去测温,看瓶外的温度改变;3)满载热穿透的玻璃瓶放置办法和跟满载热散布相同,只是温度查看探头的方位不相同,满载热穿透是把探头放置于盛满药液或水的瓶子中紧固,用于勘探瓶内温度。
以上每个期间都需求进行**少接连运转3次。这儿需求留意的是不相同的规范都需求按**大装载量去放置,而且要按正常灭菌的程序进行灭菌,否则就失去验证的含义了(当然也能够进行挑战性实验,恰当下降灭菌温度,这儿不作详述),而咱们在这个进程只需求调查数据就能够了。
还有用生物指示剂进行挑战性实验,生物指示剂的选用可根据药典,但应着重所用生物指示剂的耐热性应大于商品中多见污染菌的耐热性,用量也应大于商品中该污染菌的水平,经生物指示剂验证后,应能证实在设定的F0值条件下,商品的无菌确保水平低于10-6。
(4)**后验证完要对温度探头进行再次校对,验证前后差错均应小于0.5℃为合格。
2.3灭菌柜验证数据剖析
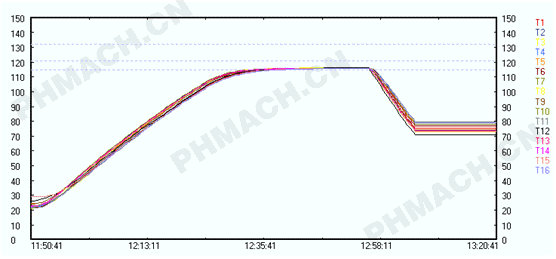
验证进程做完了,轮到**关怀的数据剖析期间,有许多人只关怀定论是不是合格?能够出产了吗?本来这是过错的,验证的中心思维是经过验证进程发现疑问,了解灭菌柜的实习作业情况(格外是每年的再验证更是如此),从而解决疑问,为日后的保护和查看提供根据与对照,才干知晓这个柜操控是不是合理、精度怎么、是不是年久失修等,有经历的人就能经过比照数据就能看出来,让灭菌柜更安稳地作业才是验证意图。
水浴式非旋转的灭菌柜温度散布特点是怎样的呢?总的来说,柜底近排水方位会相对低一些,**于哪一边温度低些则或许取决于灭菌柜的设备水平度或许由于喷淋头的阻塞情况,而柜的中心方位温度会相对温度高一些。(图3)是一个非旋转水浴式灭菌柜满载热穿透灭菌进程的温度曲线图,从上图能够看出非旋转水浴式灭菌柜柜内各点的热散布仍是比照均匀的,比蒸汽式灭菌柜要好许多,但又比旋转水浴式灭菌柜要差一些,或许这即对错旋转水浴式灭菌柜变成主流灭菌柜的要素吧。
参阅文献:
1杜春明 张弋. 大容量注射剂湿热灭菌设备的温度验证实习.我G制药装备. 2007第3期
2范志文. 水浴式灭菌柜的作业原理及其验证.2006第5期